Enlaces quimicos
Un enlace químico es la fuerza que existe entre dos o más átomos, esta fuerza es justamente lo que mantiene unidos a ambos átomos para formar las moléculas, pero es importante saber que, para enlazarse entre sí, los átomos deben ceder, aceptar o compartir electrones
Son justamente los electrones de valencia los que determinarán el tipo de enlace químico que unirá a la molécula, es decir que, según los electrones de valencia podremos saber a grandes rasgos de que forma se unirá un atomo a otro, y qué características tendrá dicho enlace.
El enlace químico es el resultado de las interacciones atractivas entre los núcleos atómicos y los electrones, que superan energéticamente a las interacciones de repulsión de los electrones entre sí y también entre los núcleos.
Para simplificar, puedes reconocer que hay básicamente tres modelos de enlace: iónico, covalente y metálico.
Enlace iónico: el enlace iónico se basa en la atracción electrostática que ocurreentre átomos que tienen cargas eléctricas opuestas entre sí, por lo que suele darse en átomos poco electronegativos y atomos muy electronegativos, además claro de que uno deberá ser capaz de ceder electrones, y el otro de aceptarlos, como por ejemplo el cloruro de sodio es un elemento con enlace iónico
Características de los enlaces iónicos
• Se forma entre un metal y un no metal.
• Los metales pierden electrones y el no metal capta electrones.
• Se forman iones cargados positivamente y negativamente, lo que hace que el compuesto iónico en su totalidad sea neutro.
Formacion de enlace ionico
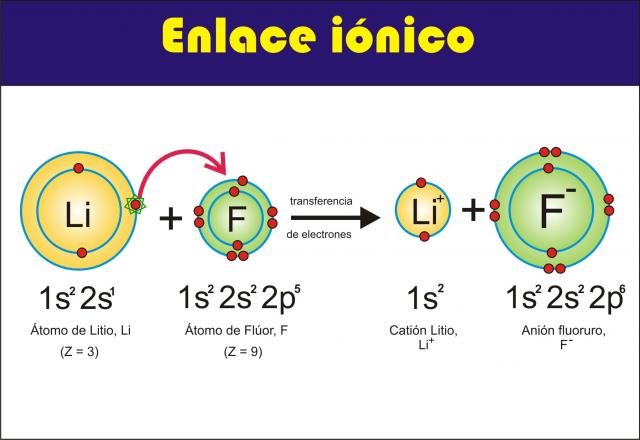
Cuando un átomo que pierde electrones con relativa facilidad reacciona con otro que tiene alta afinidad electrónica se forman sustancias iónicas; en otras palabras la formación de un compuesto iónico se debe a la reacción entre un metal y un no metal.
Enlace Covalente:
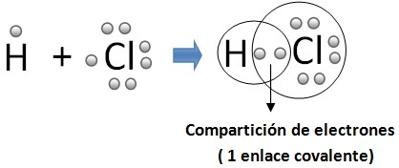
Un enlace covalente se produce por el compartimiento de electrones entre dos o más átomos. La diferencia de electronegatividades entre los átomos no es suficientemente grande como para que se efectúe una transferencia de electrones. De esta forma, los dos átomos comparten uno o más pares electrónicos en un nuevo tipo de orbital, denominado orbital molecular. Los enlaces covalentes se suelen producir entre elementos gaseosos no metales.
caracteristicas
• Los compuestos covalentes pueden presentarse en cualquier estado de la materia: solido, liquido o gaseoso.
• Son malos conductores del calor y la electricidad.
• Tienen punto de fusion y ebullicion relativamente bajos.
• Son solubles en solventes polares como benceno, tetracloruro de carbono, etc., e insolubles en solventes polares como el agua.
Si consideras el átomo de oxígeno, cuya configuración electrónica (8) es 1s2 2s2 2px2 2py1 2pz1, hay dos orbitales “p” que contienen solo un electrón y pueden ser compartidos para formar una unión o enlace doble en la molécula O2 (según puedes ver en el esquema a). Observa que cada átomo de O cumple con la regla del octeto, compartiendo electrones con el otro y alcanzando 8 electrones, estructura característica de la configuración externa del gas noble Ne (esquema b). En el esquema c se muestra otra estructura más simple, donde cada par electrónico es representado por un trazo.
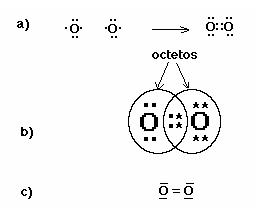
Existen tres tipo de enlace covalente que son: el polar,no polar y coordinado
No polar: Cuando la electronegatividad de los compuestos que se unen son cuantitativamente iguales, o muy cercanos por ello los electrones se mantienen cerca de los dos núcleos de forma que no existe un extremo más polar que otro.
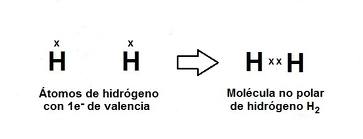
El hidrogeno es el primer elemento que presenta este tipo de enlace, por ejemplo cuando dos átomos comparten sus electrones, ambos adquieren la configuración del helio: 1s²
Átomo de hidrogeno átomo de hidrogeno electrones compartidos
Se deduce entonces que un enlace covalente no polar, es aquel que se lleva acabo cuando se unen dos átomos iguales; y por lo mismo con la misma electronegatividad.
El enlace covalente polar: ocurre entre átomos diferentes. No existe una compartición electrónica simétrica, dada la diferencia de electronegatividades existentes. Siempre hay un átomo que es más electronegativo que otro y es el que atrae hacia si el par de electrones.
El enlace es mas polar cuanto mayor es la diferencia de electronegatividades entre los átomos participantes.
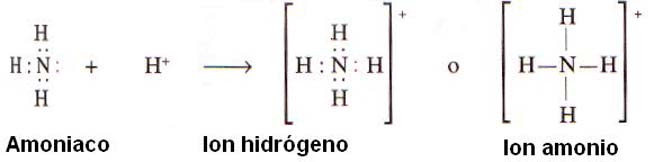
Enlace covalente coordinado
El “enlace covalente coordinado”, o también denominado “dativo”, no es una clase diferente de enlace, sino que corresponde a un enlace covalente común que se origina cuando un átomo aporta un par electrónico en un orbital y el otro átomo dispone solamente de un orbital vacío.
En este caso es uno de los átomos el que sede los dos electrones, y el otro solo ofrece el espacio para acomodarlos. Una vez formado un enlace covalente coordinado, no se distingue de los demás; no es mas que un par de electrones compartidos.
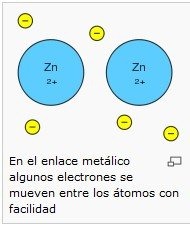
Enlace metálico
En metales, los electrones están deslocalizados en la totalidad de su estructura, esto hace que los átomos se mantengan unidos con una gran fuerza de atracción a través de lo que se llama enlace metálico.
Caracteristicas:
• La movilidad de los electrones deslocalizados hace que los metales sean buenos conductores del calor y la electricidad.
• La gran fuerza de atracción es la responsable de la resistencia del metal.
• Los metales también poseen brillo ya que sus electrones tienen la capacidad de absorber energía de la radiación y liberarla en forma de
• fotones de luz visible que nos dan esa sensación característica de brillo.
• En el metal, los átomos pueden deslizarse unos sobre otros, sin romper ningún enlace específico. Gracias a esto y aplicando una fuerza sobre el metal, es posible hacer alambres o hilos (dúctil) y formar láminas (maleables).